はじめに...
 日頃より日本医薬品添加剤協会の活動にご支援を賜り誠にありがとうございます。事業担当理事の大浜亘です。2010年より当協会の事業担当理事、2017年よりIPEC FederationのTreasurerの任を拝命し、国内外の医薬品添加剤業界の変化に触れてまいりました。当協会の任である国際調和及び、日本医薬品添加剤業界の動向情報の各PECとの共有をIPEC Federationでの活動を通して行いながら、世界の規制の変化をお伝えする方法を模索しておりました。
日頃より日本医薬品添加剤協会の活動にご支援を賜り誠にありがとうございます。事業担当理事の大浜亘です。2010年より当協会の事業担当理事、2017年よりIPEC FederationのTreasurerの任を拝命し、国内外の医薬品添加剤業界の変化に触れてまいりました。当協会の任である国際調和及び、日本医薬品添加剤業界の動向情報の各PECとの共有をIPEC Federationでの活動を通して行いながら、世界の規制の変化をお伝えする方法を模索しておりました。
今年の6月に会員の皆様へタイムリー且つ正確な情報の提供を目指すべく、協会のホームページをリニューアルし、11月より各委員会及びニュースレター編集部のサポートを頂戴しながら、ニュースレターの配信を開始することが出来ました。このニュースレターが会員の皆様の活動の一助になれば幸いです。
第18回医薬品添加剤セミナー参加受付中
毎年恒例の医薬品添加剤セミナー参加受付を開始しております。
【大阪講演】2019年2月15日エル・おおさか 午前9:30受付 午前9:55開演
【東京講演】2019年2月21日連合会館 午前9:30受付 午前9:55開演
皆様のご参加をお待ちしております。
くわしくはウェブサイトお知らせ開催案内をご覧ください。
医薬品添加剤GMP自主基準2016ガイドブックセミナー開催
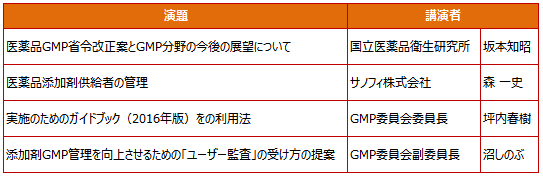
 当協会 GMP委員会主催の「医薬品添加剤GMP自主基準 2016 ■■ 実施のためのガイドブック発刊記念セミナー ■■ 添加剤GMPのグローバル化対応とその効果的な利用について」が12月6日(木)にタワーホール船堀(東京)にて開催されました。足元のお悪い中150名を超える方々にご参加いただき心より御礼申し上げます。ありがとうございました。
当協会 GMP委員会主催の「医薬品添加剤GMP自主基準 2016 ■■ 実施のためのガイドブック発刊記念セミナー ■■ 添加剤GMPのグローバル化対応とその効果的な利用について」が12月6日(木)にタワーホール船堀(東京)にて開催されました。足元のお悪い中150名を超える方々にご参加いただき心より御礼申し上げます。ありがとうございました。
詳細につきましては、会員サイトNEWSLETTER No.2 Dec.2018のトピック1をご覧ください。
PIC/S PI 045-1
「ヒト用医薬品の添加剤が適切なGMPであることを確認するための正式なリスクアセスメントに関するガイドライン」について
GUIDELINES ON THE FORMALISED RISK ASSESSMENT FOR ASCERTAINING THE APPROPRIATE GOOD MANUFACTURING PRACTICE FOR EXCIPIENTS OF MEDICINAL PRODUCTS FOR HUMAN USE
PIC/S PI 045-1ガイドラインが、本年7月1日に採択されました。本ガイドラインは、製造承認所有者(Manufacturing Authorisation Holder;MAH)に対して、ヒト用医薬品に使用する医薬品添加剤が適切なGMPによって製造されていることを確認するためにリスクアセスメントを適用することを規定するものです。このガイドラインを法的拘束力のある基準とすべきかどうかは各PIC/S加盟当局に委ねられるとされています。
また、本年同日付けで改訂されたPIC/S 医薬品GMPガイド パートI (PE 009-14)においても、出発原料(Starting Materials)に対して本ガイドライン(PI 045-1)に従って適切に添加剤及び添加剤供給業者を管理すること等が追加・改訂されました。
これらのPIC/Sガイドライン(PI 045-1及びPE 009-14)は医薬品の製造承認所有者(医薬品製造業者)が順守すべきガイドラインですが、医薬品添加剤及びその供給業者に直接影響するガイドラインですので、今回のニュースレターのトピックとして取り上げました。
PIC/S ガイドライン PI 045-1は、2015年に発出されたECガイドラインOJ 2015/C95/02をPIC/S用に転用したものですが、IPEC Federation及びIPECアメリカはこのEUガイドラインに対する見解を意見書(Position Paper)として、それぞれ2015年及び2016年に公表すると共に、業界として、このガイドラインに対応すべく“How-to Guide”(2016)、 The IPEC Risk Assessment for Pharmaceutical Excipients. Part I - Risk Assessment for Excipient Manufacturers 2017などのガイドラインを発出しております。
詳細につきましては、会員サイトNEWSLETTER No.2 Dec.2018のトピック2をご覧ください。
ICH Q3C 残留溶媒ガイドラインの改訂 −ICH Q3(R7)− ICHホームページより
本年10月に公開されたICH Q3C (R7) において、クラス2溶媒のエチレングリコール(Ethylene Glycol)のPDE値が3.1 mg/day ( オプション1の濃度限度値 310 ppm ) に変更されました(Step 4)。これはICH Q3C (R6) ガイドラインまでのエチレングリコールのPDE値の計算が間違っていたものを今回訂正したとのことです。尚、これまでのPDE値は6.2 mg/day (濃度限度値620 ppm)でした。
今後、局方、薬添規等に収載されております添加剤で、残留溶媒としてエチレングリコールを含むものについては見直し・対応の準備が必要となると思われますのでお知らせします。
| Q3C(R7) | Correction for the PDE and concentration limit for Ethyleneglycol on Table 2 page 6, as per the correct value calculated in Pharmeuropa, Vol. 9, No. 1, Supplement, April 1997 S36. | 15 October 2018 |
詳細につきましては、会員サイトNEWSLETTER No.2 Dec.2018のトピック3をご覧ください。