日本医薬品添加剤協会 |
日本医薬品添加剤協会 |
|
和名 ホウ酸 英文名 Boric Acid CAS 10043-35-3 (link to ChemIDplus), (link to JAN DB), (link to JANe DB) 別名 収載公定書 局方(JP17), 外原規(2006) USP/NF(28/23)(Borax) EP(5)(Borax) 用途 安定(化)剤,緩衝剤,等張化剤,pH調節剤,防腐剤,保存剤,溶解補助剤 ■単回投与毒性 (link to ChemIDplus), マウス及びラット 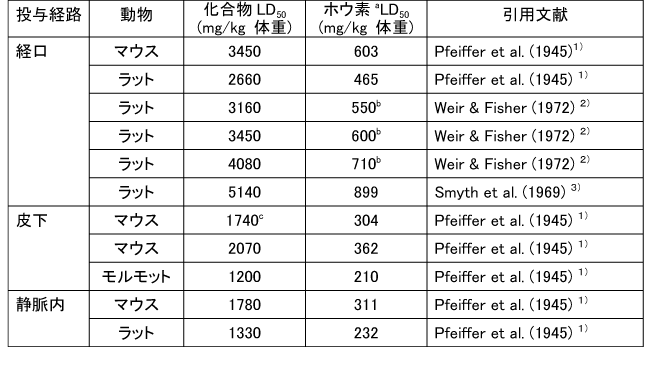 a 特に記載がない場合以外は、ホウ素化合物mg /kgの投与量にホウ素/ホウ素化合物の分子量比を掛け合わせて計算した。 b 試験者による報告 c 水酸化ナトリウムでpH7.4に調整した液 鶏 1日齢のブロイラーチキンを9.3m2の床に0, 0.9, 3.6, 7.2 kgのホウ素をまいた檻に入れた。15日後、平均体重は、0, 3.6, 7.2 kgのホウ素群でそれぞれ340.7 g, 278.1 g, 213.2 gであった (P < or = 0.05) 。0 及び7.2kg群の飼料要求率は、それぞれ1.68と2.29であった(P < or = 0.05)。次の試験で、2500 または5000 ppmのホウ酸を2週間摂取させた後の体重はそれぞれ254.8 g と149.6 gであった。コントロール群のチキンの体重は平均285.0 g (P < or = 0.05)であった。5000 ppm群の飼料要求率は1.70であり、コントロール群では1.45 (P < or = 0.05)であった。用量依存的な羽毛異常がホウ酸摂取チキンでみられた。明らかな組織学的変化はみられなかった。ホウ酸をまいて暴露させた結果として、居住性、体重増加、飼料要求率に有害な変化はみられなかった。4)(Dufour L. et al.) ■反復投与毒性 (link to TOXLINE) 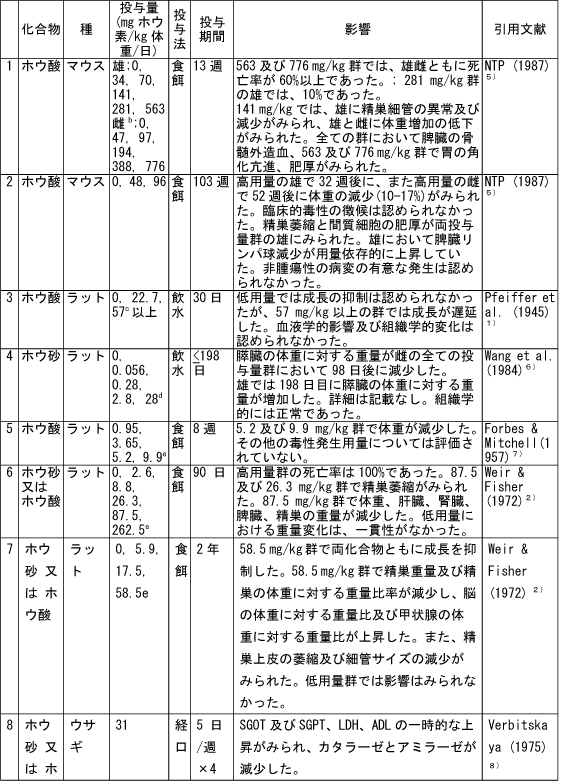 aホウ素化合物mg /kgの投与量にホウ素/ホウ素化合物の分子量比を掛け合わせて計算した。 b 投与4週目において雄161g/kg群、雌222g/kg群の摂餌量を基に見積もった。 c 著者の報告による0.12-0.14 ml/g 群の飲水量を基に計算した。 d 体重を0.35 kgと仮定したとき1日の飲水量が19.5 mlであると報告されていることを基に計算した。 e ラットで体重0.35 kgの場合、1日の飲水量が0.049L、または摂餌ファクターがラットで0.05、イヌで0.025、またはマウスの体重が0.03 kgで1日の飲水量が0.0057Lであると仮定して計算した。 ■遺伝毒性 (link to CCRIS) Salmonella typhimuriumを用いてラットまたはハムスターのS9フラクション存在下及び非存在下で突然変異原性を調べたところホウ酸には突然変異原性は認められなかった。(Haworth et al., 19839) ; Benson et al., 1984 10); NTP, 19875)) また、マウスリンパ球L5178Y/TK+/?細胞を用いてラット肝臓S9の存在下及び非存在下でも突然変異原性は認められなかった。 (NTP, 19875); McGregor et al., 1988 11) ). Salmonellaを用いてラット肝S9存在下及び非存在下で突然変異原性を調べたところホウ砂には突然変異原性は認められなかった。(Benson et al., 1984 10)). 精製ホウ砂、天然ホウ砂及びkermite oreはV79チャイニーズハムスター細胞、C3H/1OT1/2 マウス胚芽線維芽細胞またはdiploid human foreskin fibroblastsで突然変異原性はみられなかった。(Landolph, 1985 12)) ホウ酸は、チャイニーズハムスター卵巣細胞で染色体異常または染色体交換は引き起こさなかった。(NTP, 19875)) ■がん原性 (link to CCRIS) B6C3F1マウスへの2年間の投与試験において、癌原性の徴候は認められなかった。 (NTP, 19875); Dieter, 1994 13)) ラットでの試験で、全ての組織を検査したが、ホウ酸に関連した癌原性の徴候は認められなかった。(Weir & Fisher, 19722) ) US EPAは、ヒトでのデータがないこと、及びこれら2つの動物試験のデータを基に、ホウ素はGroup Dの化学物質(ヒトに対する発がん性については分類できない物質)に分類している。(US EPA, 1994 14) ) ■生殖発生毒性 (link to DART) 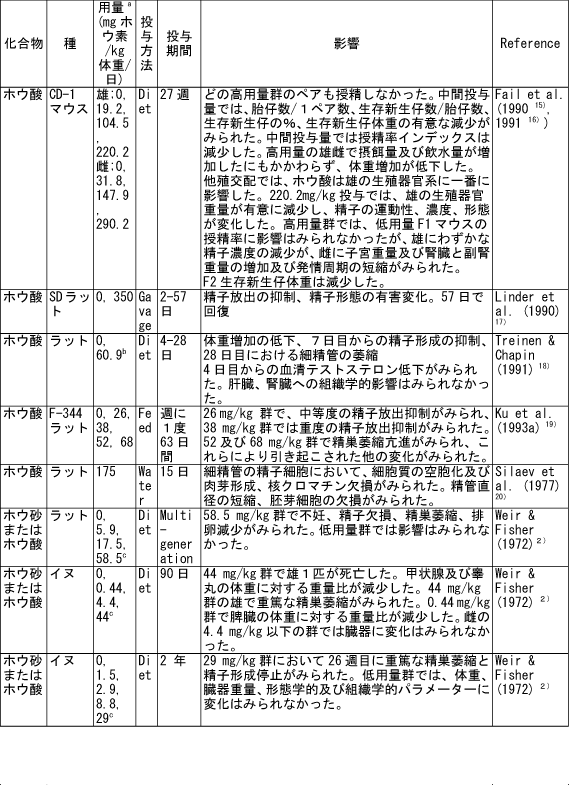 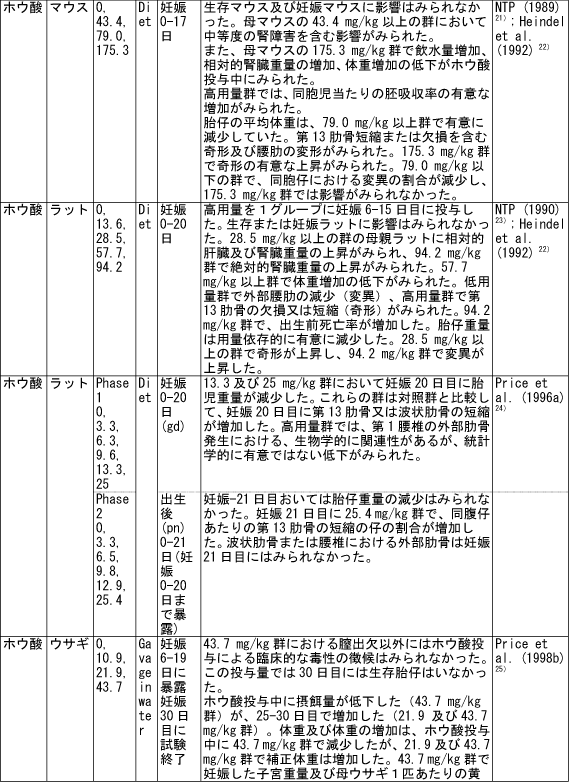 a ホウ素化合物mg /kgの投与量にホウ素/ホウ素化合物の分子量比を掛け合わせて計算した。 b 著者による見積もり。 c ラットで体重0.35 kgの場合、1日の飲水量が0.049L、または摂餌ファクターがラットで0.05、イヌで0.025、またはマウスの体重が0.03 kgで1日の飲水量が0.0057Lであると仮定して計算した。 d 体重を0.35 kgと仮定し、1日の飲水量が19.5 mlであると報告されていることを基に計算した。 ■局所刺激性 ホウ酸(5 ml, 10%水溶液, w/v)及びホウ砂(10 ml, 5%水溶液, w/v)は、掻破した皮膚に塗布後24-72時間後に軽微な皮膚刺激性があった。モルモットに塗布したとき、24時間及び72時間後にホウ砂で軽微な、またホウ酸では中等度の皮膚刺激性がみられた。26)(Roudabush et al.1965) ラットに1日88または263 mg ホウ素/kgをホウ砂またはホウ酸として投与したとき、四肢と尾に充血及び皮膚落屑がみられた。2) (Weir & Fisher, 1972). ■その他の毒性 該当文献なし ■ヒトにおける知見 (link to HSDB) 誤用 グルコース試験中にグルコース溶液と間違えて40gホウ酸を摂取した62歳男性。18時間の血液透析で8.32gのホウ酸が排出され、利尿剤にて8.6gが、また胃洗浄により少なくとも9gを除去した。毒物大量摂取により嘔吐が発現した。最も重要な症状は、代謝性アシドーシス、14時間の尿閉、正色素性貧血であった。腎臓損傷または他の影響はみられなかった。27)(Stolpmann R. et al., 1975) 44歳黒人女性。自殺未遂後、急性ホウ酸中毒の典型的な症状が発現した。広範囲に渡る落屑を伴った全身紅斑があらわれた。28)(Schillinger BM. et al., 1982) ホウ酸を高濃度処方薬の希釈のために使用し、生後24日と14ヶ月の兄弟に摂取させた。総摂取量は、それぞれ2.6gと1.95gであった。副作用症状は、興奮、下痢、会陰紅斑(小さいほうの子のみ)であった。最高ホウ酸血中濃度は、24日児で147 μg/ml、14ヶ月児で56μg /mlであった。小さい子には、腹膜透析を行い、一方上の子には症状の治療のみを行った。血中ホウ酸半減期は、約10時間(24日児)及び8時間であった。どちらの子供も重篤な副作用は発現せず、1ヶ月間の経過観察では無症状であった。29) (Baker MD et al., 1986) 歯痛のため処方された3gのホウ酸と300mgの塩酸シンコカインの混合物を12ヶ月令の女の子が誤って摂取した。激しい嘔吐と咳が発現。興奮、振戦、痙攣発作及びせん妄がみられた。ジアゼパム、挿管、鎮静及び気管内挿管により治療した。またフロセミドと点滴により利尿を行った。最初の24時間以内に血液透析を2回行った。腎機能には影響がなかった。2日で完全に回復した。ホウ酸及び塩酸シンコカインの最高血中濃度は、摂取約6時間後でそれぞれ26μg/ml and 71 ng/mlであった。ホウ酸の血漿半減期は7.0時間で2回の透析で3.6時間及び4.4 時間に短縮された。ホウ酸の全身クリアランスは、21 ml/minから41 及び34 ml/minに増加した。ホウ酸の透析のin vitroクリアランスは、18 ml/minともっと少ないことが判明している。腎毒性の徴候がない患者においても薬剤排泄を増大させるので、ホウ酸の中毒の治療において透析はとても有用であることを示唆している。30)(Egfjord M et al., 1988) ホウ酸摂取の臨床転帰を確認するため、また血清ホウ酸濃度と臨床的症状の間の関連性を評価するために2つの毒性センターにおいてレトロスペクティブなレビューを行った。784例を対照とした。2例以外は急性摂取であった。重篤な症状の患者はおらず、88.3%が無症状であった。最も一般的な症状は、嘔吐、腹痛、下痢であった。倦怠感、頭痛、めまい、非定型性発疹がまれにみられた。血中ホウ酸濃度は、51例で測定され、0 から340 μg/mlであった。7例では血中濃度が70μg/ml以上であったが、4例は無症状のままであり、一方他の3例は嘔気または嘔吐がみられた。これらの7例のうち4例に透析を施行し、このうち1例のみに嘔吐がみられた。9例のデータを基に血中ホウ酸半減期は13.4時間(4.0 から27.8時間)と算出された。透析3例は透析前と透析後を比較すると有意に半減期が短縮されていた。これらの結果より、急性ホウ酸摂取はわずかな症状または無症状であり、積極的治療はほとんどの患者では必要ないことが示唆された。31)(Litovitz TL et al., 1988) 26歳女性が約21gのホウ酸摂取による7時間後自殺後、嘔吐、痙攣n、発熱、発疹及び意識不明の状態で搬送された。活性炭と下剤(MgSO4)投与後に続きすぐに胃洗浄をおこなった。排尿を促すため利尿剤(フロセミド)を入れた点滴を行った。ホウ酸の血清濃度がとても高かったので、最初の39時間に2回の透析を行った。患者は治療に良好に反応し、入院後12日で続発症なく退院した。ホウ酸の血清及び尿中濃度は、修正Miyamoto法で適当な間隔で測定し、ホウ酸の体内動態を分析した。ホウ酸の血清及び尿中濃度は、治療開始時はそれぞれ465 μg/ml及び3.40 mg/mlであった。ホウ酸の半減期は、13.46時間であり、一方透析により3.76時間に短縮された。全身クリアランスは、0.99 l/hで透析により3.53 l/hに増加した。血液透析による追加のホウ酸排泄量は約5gと算出される。従来の治療よりも血液透析によりホウ酸の排出が4倍となったので、ホウ酸中毒の治療には血液透析はとても有用であることが示唆された。32)(Teshima D et al., 1992) ホウ酸中毒による疾患の発生が51例で発現した。1990年2月11日、患者らはパキスタン、イスラマバードでの国際振興のためのUSエージェンシーのカフェテリアでランチを食べた。ランチ摂取後、2から4時間後に頭痛、重篤な筋肉痛が発現した。発熱、嘔気、嘔吐、目の充血、羞明も報告された。25例(49%)に顔面の熱傷様炎症が発現しその後落屑となった。1例が脱水のため1日間の入院を要した。ランチ摂取後72時間すべての患者にみられた症状は、軽微な頭痛、倦怠感、皮膚剥離であった。症状が発現したこれらの患者はある一つの特定の料理(ミネストローネスープ)を食べた可能性が高かった。同様の病状がホウ酸摂取後に発現すると記載されている。しかしながら、24例からランチ後3日間採取した血清サンプルの分析の結果、ホウ素平均基礎濃度以上とはなっていなかった。しかしホウ素の半減期は短いため、これらのデータは患者が症状が発現した辞典でのホウ素濃度はもっと高かった可能性は除外できない。33)(Tangermann RH et al., 1992) 45歳白人男性がホウ酸結晶を約2カップを水に溶かして摂取し自殺を図った。嘔気、嘔吐、緑様下痢、脱水がすぐに発現した。2日後、患者は低血圧、代謝性アシドーシス、腎障害、全身性紅斑、表皮剥離で入院した。点滴、昇圧剤投与にもかかわらず、患者の状態は改善しなかった。その後頻拍性心房細動が発現し、洞拍動が改善しなかった。拍動は悪化し、患者は入院17時間後に死亡した。尿及び血中ホウ酸濃度は、ホウ酸摂取約五2時間後でそれぞれ160と42mg/dLであった。これらの結果は、血中ホウ素濃度としては28及び7 mg/dLと同等である。死後の尿中ホウ素濃度は29.4mg/dLであった。剖検では死因はホウ素中毒が報告されている。患者は3日間無処置で脱水と腎障害を有していたので、本症例は近年唯一報告されたホウ酸摂取による死亡例であり、代表例であろう。本性例は、適切な尿排泄ができず、脱水がホウ素毒性のリスクを高めたことが示唆された。34)(Restuccio A et al., 1992) 77歳男性がしゃっくりを止めるために誤って30gのホウ酸を単回経口摂取した。入院時、法と、下痢、しゃっくりがあった。検査データでは、急性腎障害と診断された。血液透析及びチャコール血液循環を施行した。ホウ酸の血清濃度は、治療により減少したが、患者は心不全のため死亡した。成人において単回経口摂取により発現した急性のホウ酸毒性の報告はまれである。本症例は1920年から成人では4例目のホウ酸の単回急性摂取による死亡例である。35)(Ishii Y et al., 1993) その他 酸化ホウ素は動物試験において呼吸器粘膜及び結膜を刺激することが示されている。本試験は、ヒトにおいて酸化ホウ素とその水和物であるホウ酸の暴露が呼吸器と目に刺激をあたえるかどうかを検討するため行った。にこれらの物質を暴露した113例の労働者と214名の非暴露労働者に症状について質問をした。目への刺激、口、喉、鼻の渇き、喉の痛み、咳に統計学的に有意差がみられた。平均暴露量は4.1 mg/m3であった。36) (Garabrant DH et al., 1984) ロッキーマウンテン毒性薬物センターで1983年1月から1984年8月に報告を受けた10gから297gのホウ酸急性単回摂取後のホウ酸血中濃度は4例で上昇していた。全身的な症状はみられなかった。1983-4年で364例のホウ酸暴露症例が報告され、1例が恐らく慢性摂取により死亡した。嘔吐、嘔気、下痢、腹痛が多くみられた。全身的な症状は急性摂取ではみられなかった。364例中5例が血中濃度を測定しており、1例のみみが入院した。1984年に報告された治療記録が完全な72症例のうち79%が無症状であり、一方20%に軽微な消化管症状がみられた。2歳の子供1例が死亡したが、恐らく99%ホウ酸含有殺虫剤の繰返し摂取によるものと思われる。これらの所見から、ホウ酸の急性単回摂取から毒性の症状はあらわれないことが示された。血中ホウ酸濃度は、急性摂取後の臨床的症状とあまり関連していなかった。37)(Linden CH et al., 1986) ホウ酸中のホウ素全身暴露(例えば摂取)は、可逆的な脱毛と関連している。皮膚ホウ素暴露により可逆的な脱毛となった2つの職場での3患者を診察した。頭皮脱毛は1例では全体的に2例では斑点状であった。脱毛はホウ素含有物質の除外または暴露の減少によりすべての患者が回復した。ホウ素の職業的局所暴露は可逆的な脱毛を引き起こす。38)(Beckett WS et al., 2001) ■参考文献 小児(link to STEP database;要Login) 1)Pfeiffer CC, Hallman LF, & Gersh I; J Am Med Assoc, 128: 266-274(1945). 2)Weir RJ & Fisher RS; Toxicol Appl Pharmacol, 23: 351-364(1972). 3)Smyth HF Jr et al.; Range finding toxicity data: List VII. Am Ind Hyg Assoc J, 30: 470-476(1969). 4)Dufour L et al.; Avian Dis. 36(4):1007-11(1992) 5)NTP (1987) Toxicology and carcinogenesis studies of boric acid (CAS No. 10043-35-3) in B6C3F1 mice (feed studies). Research Triangle Park, North Carolina, US Department of Health and Human Services, National Toxicology Program (NTP TR No. 324). 6)Wang E. et al.; Zhonghua Yufangyixue Zazhi, 18(1): 20-22(1984) 7)Forbes RM & Mitchell HH; Arch Ind Health, 16:489-492(1957). 8)Verbitskaya GV; Gig i Sanit, 7: 49-53 (1975). 9)Haworth S et al.; Environ Mutagen, 1(Suppl): 3-142(1983). 10)Benson WH et al.; Environ Toxicol Chem, 3: 209-214(1984). 11)McGregor DB et al.;Environ Mol Mutagen, 12: 85-154(1988). 12)Landolph JR; Am J Ind Med, 7: 31-43(1985). 13)Dieter MP; Environ Health Perspect, 102(Suppl 7):93-97(1994). 14)US EPA (1994) Integrated risk information system--Online. Cincinnati, Ohio, US Environmental Protection Agency, Environmental Criteria and Assessment Office. 15)Fail PA et al.; Final report on the reproductive toxicity of boric acid (CAS No. 10043-35-3) in CD-1 Swiss mice. Research Triangle Park, North Carolina, US Department of Health and Human Services, National Toxicology Program (NTP Report No. 90-105) (1990). 16)Fail PA et al,; Fundam Appl Toxicol, E17: 225-239(1991). 17)Linder RE et al.; J Toxicol Environ Health, 31: 133-146(1990). 18)Treinen KA & Chapin RE; Toxicol Appl Pharmacol, 107: 325-335(1991). 19)Ku WW et al.; Reprod Toxicol, 7: 305-319(1993a). 20)Silaev AA et al,; Bull Exp Biol Med (USSR), 83: 588-591(1977). 21)NTP (1989) Final report on the developmental toxicity of boric acid (CAS No. 10043-35-3) in CD-1-Swiss mice. Research Triangle Park, North Carolina, US Department of Health and Human Services, National Toxicology Program (NTP Report No. 89-250). 22)Heindel Jj et al.; Fundam Appl Toxicol, 18: 266-277(1992). 23) NTP (1990) Final report on the developmental toxicity of boric acid (CAS No. 10043-35-3) in Sprague-Dawley rats. Research Triangle Park, North Carolina, US Department of Health and Human Services, National Toxicology Program (NTP Report No. 90-105). 24) Price CJ et al.; Fundam Appl Toxicol, 32: 179-193(1996a). 25) Price CJ et al.; Fundam Appl Toxicol, 34: 176-187(1996b). 26) Roudabush RL et al.; Toxicol Appl Pharmacol, 7: 559-565(1965). 27) Stolpmann R. et al.; Dtsch Med Wochenschr. 1975 Apr 18;100(16):899-901 28) Schillinger BM. et al.; J Am Acad Dermatol. 1982 Nov;7(5):667-73. 29) Baker MD et al.; Am J Emerg Med. 1986 Jul;4(4):358-61. 30) Egfjord M et al.; Hum Toxicol. 1988 Mar;7(2):175-8. 31) Litovitz TL et ak.; Am J Emerg Med. 1988 May;6(3):209-13. 32) Teshima D et al.; J Pharmacobiodyn. 1992 Jun;15(6):287-94. 33) Tangermann RH et al.; Arch Environ Contam Toxicol. 1992 Jul;23(1):142-4. 34) Restuccio A et al.; Am J Emerg Med. 1992 Nov;10(6):545-7 35) Ishii Y et al.; J Toxicol Clin Toxicol. 1993;31(2):345-52 36) Garabrant DH et al. ; J Occup Med. 1984 Aug;26(8):584-6. 37) Linden CH et al.; J Toxicol Clin Toxicol. 1986;24(4):269-79. 38) Beckett WS et al.; J Am Acad Dermatol. 2001 Apr;44(4):599-602 |メニューへ| |
| Japan Pharmaceutical Excipients Council |